Комбинированный урок по химии в 8 классе с использованием презентации
Автор: Шустикова Ольга Валентиновна, учитель химии и биологии ГБОУ Школа 1381 г. Москва
Программа Е.Е. Минченкова. Учебник Минченков Е.Е., Зазнобина Л.С., Смирнова Т.В. ХИМИЯ: учебник для 8 класса средней общеобразовательной школы. – Смоленск: Ассоциация XXI век, 2006
Тема 2 «Важнейшие классы неорганических веществ. Типы химических реакций»
Урок 4/26 Кислоты, их состав. Взаимодействие кислот с
металлами. Реакции замещения. Понятие о солях.
Цели урока (Целеполагание):
Воспитательная:
воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
воспитание личностных качеств ученика – активности, самостоятельности, творчества, сотрудничества, общительности, коммуникативности.
Развивающая:
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
развитие мыслительных способностей – сопоставление, сравнение, анализ, синтез, умение делать выводы.
Обучающая: организовать деятельность учащихся на усвоение:
знаний о составе, формулах, физических, химических свойствах и применении кислот;
умений определять кислоты из ряда, характеризовать физические свойства кислот, составлять уравнения, характеризующие свойства кислот, экспериментально доказывать химические свойства кислот, определять тип химической реакции;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Реактивы и оборудование: разбавленный раствор соляной кислоты, гранулы цинка, проволока меди, компьютер, проектор, презентация, индивидуальные лисы рефлексии (Приложение 1)
ЭТАПЫ УРОКА:
Организационный момент Слайд 1
Актуализация знаний (необходимо вспомнить те знания, которые потребуются на основном этапе урока)
РЕФЛЕКСИЯ (НАЧАЛО УРОКА)
Каждому ученику выдается индивидуальный лист рефлексии
(Приложение 1) Сначала дети заполняют первую таблицу индивидуального листа (что знают хорошо, что вызывает затруднения), затем выполняют тест, после которого на экране сразу выводятся ответы и учащиеся сами себя оценивают.
Слайды 2-12
1. Утверждение, в котором речь идет о сере как химическом элементе
1) кристаллическая сера желтого цвета
2) сера входит в состав сероводорода
3) сера плавится при температуре 1130С
4) серу используют для получения резины.
2. Оцените следующие суждения о свойствах кислорода:
А) Хорошо растворим в воде;
Б) Тяжелее воздуха.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Расставьте коэффициенты в уравнении реакции, схема которой
Al + О2→Al2О3
Коэффициент перед формулой кислорода равен
1) 1 2) 2 3) 3 4) 4
4. Реакцией соединения является
1) 4P + 5O2 = 2P2O5
2) MgCO3 = MgO + CO2
3) CН4 = С + 2H2
4) Cu(OH)2 = CuO + H2O
5. Химической формулой оксида алюминия является:
1) Al2О3
2) Al(ОН)3
3) AlН3
4) AlCl3
6. Формулы кислотного оксида и основного оксида соответственно
1) K2O и Mg(OH)2
2) HCl и H2O
3) SO3 и Li2O
4) BaO и Li2O
7. Оксиды, взаимодействующие между собой
1) K2O и Na2O
2) SO3 и H2O
3) FeO и H2O
4) Li2O и MgO
8. Реагируют с водой оба оксида пары
1) CuO, SiO2
2) Na2O, SO3
3) Fe2O3, CaO
4) Al2O3, СО2
9. Установите соответствие между формулой вещества и его
относительной молекулярной массой: для каждой позиции из первого
столбца выберите соответствующую позицию из второго столбца,
обозначенную цифрой.
ФОРМУЛА ОТНОСИТЕЛЬНАЯ
МОЛЕКУЛЯРНАЯ МАССА
А) SO2 1) 98
Б) СuO 2) 80
В) H3РO4 3) 64
Г) H2SO4
10. На рисунке изображен прибор для получения кислорода разложением перманганата калия, который собрал Вася на практической
р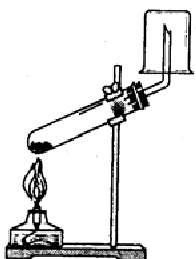 аботе. Учитель заметил, что прибор собран неверно. Какие, на
аботе. Учитель заметил, что прибор собран неверно. Какие, на
Ваш взгляд, необходимо внести изменения:
1) закрепить пробирку вертикально
2) повернуть стакан донышком вниз
3) горелку поднять выше
4) закрепить пробирку горизонтально
5) стакан заменить пробиркой
Ответ: ____________(Запишите цифры в порядке возрастания)
Целеполагание Слайд 13
Вопрос классу: Посмотрите на тему урока, давайте предположим, какую цель мы должны выполнить на уроке?
Вместе с учениками формулируем основную цель урока – получение знаний о составе, формулах, физических, химических свойствах и применении кислот.
Изучение нового материала Слайды 14-19
Прочитайте текст и выполните задания:
Уксусная кислота. «Древесная кислота» (около 3 тыс. лет).
Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Знаете ли вы, что слово «уксус» происходит от греческого слова «оксос», означающего «кислый»? Почему уксусная кислота оказалась первой, понять нетрудно. С древнейших времён люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его, видимо, выливали, а потом научились использовать как лекарство, приправу к пище, как растворитель красок. В России уксус, т.е водный раствор уксусной кислоты, называли «кислая влажность» или «древесная кислота».
Серная кислота (Х в.)
С серной кислотой люди познакомились значительно позднее, примерно в Х в. Честь её открытия приписывается персидскому химику Абубекару аль Рези. Но это установлено не совсем точно. По крайней мере серную кислоту человечество знает около 1000 лет. Серную кислоту выделили из купоросов, например из железного купороса, и соответственно назвали купоросным маслом. Именно под таким названием серная кислота была известна в России.
Соляная и азотная кислоты были выделены и определены химиками примерно в ХV в.
Соляную кислоту называли соляным спиртом, а азотную кислоту – селитряной водкой. Получали эти кислоты с помощью серной кислоты, которую потом поэтично стали называть «матерью всех кислот».
Угольная кислота (ХVIII в.)
Угольную кислоту получил впервые в конце ХVIII века Джозеф Пристли, английский химик, он же священник. Для этого он растворял в воде углекислый газ. Раствор углекислого газа в воде назвали содовой водой, а так как она получила широкое применение как напиток, за это открытие Д. Пристли наградили золотой медалью.
К концу ХVIII в. химики уже знали более десятка кислот.
| Таксономия мыслительных умений Б. Блума | Задания на основе таксономии Б.Блума | Формируемые информационные умения |
| Знание | Прочитайте текст. Вспомните определение «кислота». Перечислите известные вам кислоты, найдите их формулы в учебнике. Как получал угольную кислоту Джозеф Пристли? Слайды 14, 15 | Умение работать с письменными текстами, внимательное восприятие и запоминание информации, управление вниманием, умение рационально запоминать, логически осмысливать учебный материал. |
| Понимание | Используя жизненный опыт и бытовые знания, расскажите о физических свойствах кислот. Где они применяются? Слайды 16, 17 | Умение работать коллективно, умение ориентироваться в своей системе знаний.
|
| Применение | Проклассифицируйте угольную и соляную кислоты: В чем их отличие? Слайд 18 | Умение работать с письменными текстами, с книгой, умения самостоятельно добывать знания, осуществлять наблюдения и на основе их формулировать выводы, планировать предстоящую работу, рационально организовывать ее выполнение.
|
| Анализ | Проведите эксперимент - взаимодействие разбавленного раствора соляной кислоты с цинком и медью. Проанализируйте и объясните результат эксперимента. | Умение анализировать, умение работать коллективно, умение осуществлять наблюдения и на основе их формулировать выводы.
|
| Синтез Оценка | Составьте УХР взаимодействия кислот с металлами, дайте названия продуктам. Назовите тип реакции. Обобщите полученные знания, сделайте вывод о проделанной работе. Слайд 19 | Умение синтезировать, планировать предстоящую работу, рационально организовывать ее выполнение, осуществлять самоконтроль и умение работать в определенном темпе, умение обобщать и делать выводы. |
Контекстная задача Слайды 20-23
Прочитайте текст и выполните задания:
Зачастую газеты публикуют сообщения о том, что кто-то был обожжен кислотой. И действительно, считается, что кислоты — это очень опасные жидкости, которые вызывают ожоги кожи, прожигают ткани. Некоторые кислоты опасны для человека, но полезны в промышленности - применяются в производстве лекарств, красок, косметики и промышленных товаров Другие необходимы для жизнеобеспечения человека и присутствуют в пищевых продуктах. Кислоты, которые присутствуют в продуктах питания, необходимы для здоровья. Есть кислоты, которые вырабатываются нашим организмом и необходимы для его жизнедеятельности.
Существует множество видов кислот, но все они могут быть разделены на два класса — неорганические и органические кислоты.
Соляная кислота – «дымящая» на воздухе, едкая жидкость. Получают ее растворением газообразного хлороводорода в воде, а хлороводород синтезируют обычно из простых веществ – водорода и хлора. Полученная таким способом кислота называется синтетической. В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии серной кислоты на поваренную соль при слабом нагревании, образующийся при этом хлороводород так же растворяют в воде. Соляная кислота используется в производстве различных химических соединений и при очистке поверхностей металлов. В организме человека производится незначительное количество слабой соляной кислоты, используемой при переваривании пищи.
Концентрированная серная кислота при обычных условиях тяжёлая маслянистая жидкость без цвета и запаха. Широко используется в промышленном производстве. Оказывает вредное воздействие на глаза и вызывает ожоги кожи. Азотная кислота тоже оказывает вредное воздействие на глаза и кожу. Борная кислота используется при изготовлении керамики, цементов, косметики. Иногда ее используют для борьбы с микробами. Угольная кислота получается из углекислого газа, некоторое ее количество добавляют во фруктовые напитки. Мышьяковая кислота используется при производстве дезинфицирующих средств.
Самыми известными органическими кислотами являются уксусная, муравьиная, лимонная, молочная. Уксусная кислота содержится в уксусе, ее можно получить при брожении яблочного сидра. При образовании сахара в молоке образуется молочная кислота. Она окисляет молоко, но также используется в производстве сыра. Применение аминокислот способствует поддержанию крепкого здоровья, их мы получаем с белковой пищей. Апельсины, лимоны и грейпфруты содержат аскорбиновую кислоту — это химическое название витамина С. Никотиновая кислота присутствует в печени, мясе домашней птицы, говядине, она препятствует развитию кожных болезней.
Задания:
Прочитайте самостоятельно текст, подумайте, в чем опасность кислот для организма человека? Какие кислоты опасны, а какие полезны? В чем их польза? Приведите примеры из бытовой жизни. Слайд 20
Используя данный текст и дополнительную литературу, заполните таблицу: Слайды 21-23
| Неорганические кислоты | Органические кислоты |
| Химическая формула | Название | Химическая формула | Название |
| 1 2 3 |
| 1 2 3 |
|
В тексте описаны способы получения соляной кислоты. Запишите уравнения соответствующих реакций. Являются ли, по вашему мнению, эти способы получения кислоты оптимальными? Если да, обоснуйте свою позицию. Если нет, предложите свой способ.
Решите задачу: Сколько литров хлороводорода образуется при действии раствора серной кислоты на 117 г поваренной соли (по способу алхимиков)
Перечислите на примере соляной кислоты химические свойства кислот. Запишите уравнения реакций.
Где в организме человека производится небольшое количество соляной кислоты? В каких процессах жизнедеятельности человека она участвует?
Как вы можете помочь человеку, получившему химический ожог кислотой?
Совершенствование знаний и умений
Работа в парах: Слайд 24
Дайте определение кислота.
Состав каких кислот вы изучили?
Что общего в формулах этих кислот?
Какими свойствами обладают кислоты?
Как кислоты реагируют с металлами?
Какие реакции называются реакциями замещения?
Почему кислоты обладают общими свойствами?
Рефлексия, подведение итогов урока Слайд 25
Вспоминаем первоначальную цель, вместе с ребятами обсуждаем, выполнена ли она в ходе урока?
Что нового вы узнали о кислотах?
Что вызвало больший интерес?
Что на уроке не понравилось? Давайте вместе подумаем, что надо сделать, чтобы следующий урок был интересней?
Какой цвет больше подходит к вашему эмоциональному состоянию на уроке? Закрасьте в листе рефлексии квадрат этим цветом.
Домашнее задание Слайды 26, 27
Используя дополнительную литературу, заполните таблицу:
| Название вещества | Формула | Применение |
| Соляная кислота
Серная кислота
Азотная кислота |
|
|
Найдите дополнительную информацию о свойствах кислот и разработайте презентацию на основе найденной информации.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ:
[1] Учебник Е. Е. Минченков «Химия-8»
[2] ФГОС среднего (полного) общего образования по химии (базовый уровень)
[3] Тексты диагностических работ МИОО
[4] Задания курсов ХИ-10 МИОО «Проектирование педагогической деятельности учителя в свете образовательных стандартов нового поколения»
[5] Интернет-источники информации
 10. Оценка
10. Оценка акой цвет больше подходит к вашему эмоциональному состоянию на уроке? Закрасьте квадрат этим цветом.
акой цвет больше подходит к вашему эмоциональному состоянию на уроке? Закрасьте квадрат этим цветом.


 аботе. Учитель заметил, что прибор собран неверно. Какие, на
аботе. Учитель заметил, что прибор собран неверно. Какие, на






























